光コムを用いて共焦点性・光位相コントラスト・スキャンレス性を実現した光学顕微鏡を開発~透明・非蛍光性な細胞のライブ観察やナノメートル凹凸を有する微小半導体部品の品質検査への応用に期待~
重点クラスター(No.1702003)所属の安井武史教授の研究成果がアメリカ光学会(The Optical Society)の電子ジャーナル「Optica」で公開されます。
【ポイント】
- 共焦点顕微鏡の画像コントラストは、光強度に基づいているため、透明・非蛍光性サンプルやナノメートル凹凸サンプルへの適用が制限されていた。
- 共焦点顕微鏡は点計測に基づくため、画像取得には焦点位置の機械的走査(スキャン)が必要になり、高速イメージングが困難であった。
- 光コムと波長・空間変換を用いることにより、光位相と光振幅に基づいた共焦点顕微鏡画像を機械的走査無く(スキャンレスで)高速に一括取得可能な手法を開発した。
- 3次元培養細胞の時系列モニタリングや微小半導体部品のナノメートル欠陥検出への応用が期待される。
■主な内容
JST戦略的創造研究推進事業において、徳島大学大学院社会産業理工学研究部の長谷栄治客員准教授、南川丈夫准教授、安井武史教授らと、宇都宮大学オプティクス教育研究センターの山本裕紹准教授、電気通信大学大学院情報理工学研究科の美濃島薫教授らの共同研究グループは、光位相と光振幅に基づいた共焦点顕微鏡画像をリアルタイムで計測する技術の開発に成功しました。
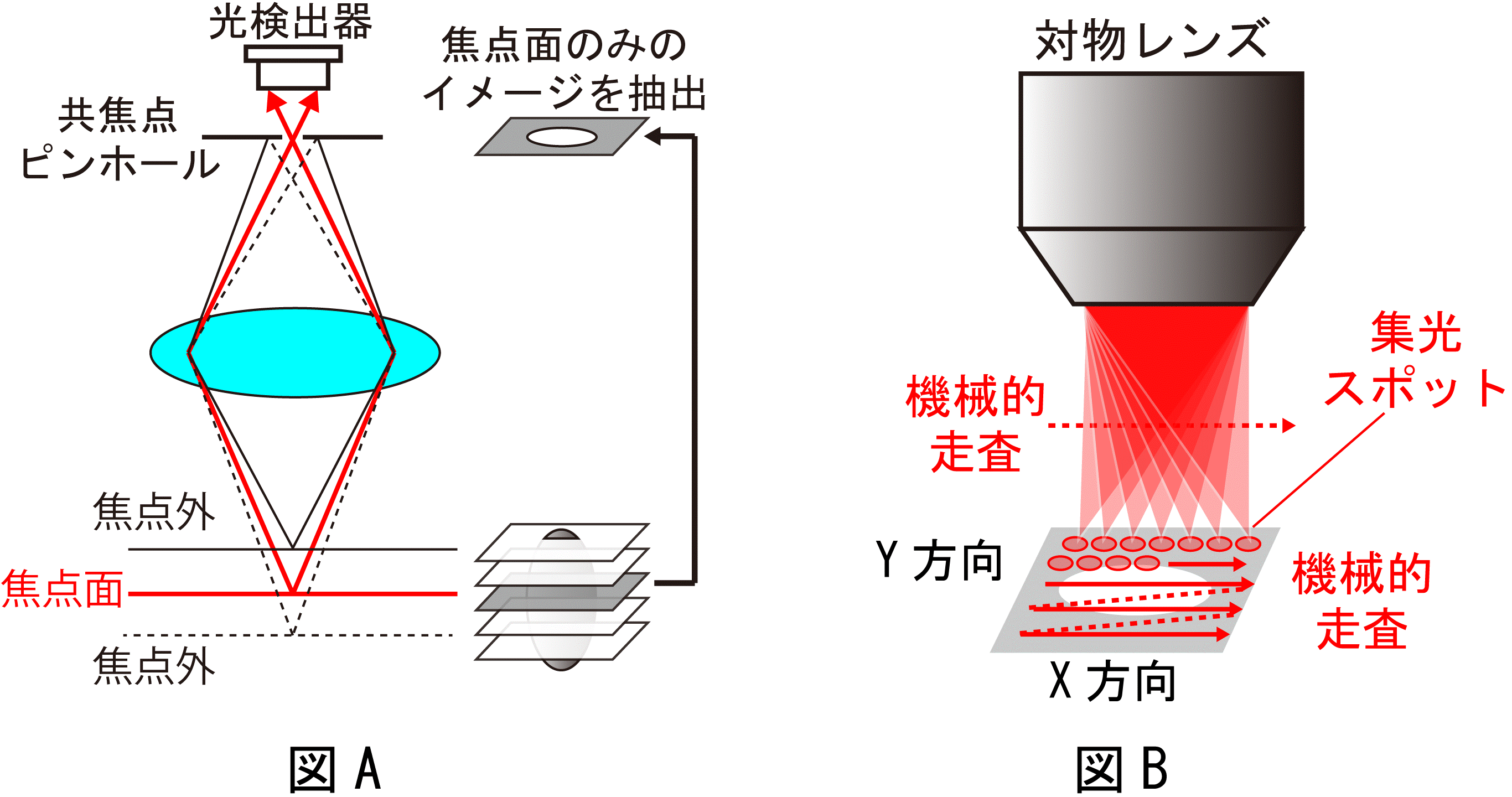
共焦点顕微鏡注1は、共焦点効果による深さ分解能と迷光除去能力を持ち、3次元イメージングが可能であることから、バイオイメージングや非接触表面形状測定の分野で広く用いられています。しかし、光強度信号に基づいて画像化しているため、測定対象は反射性、散乱性、吸収性、または蛍光性である必要があり、透明で非蛍光性のサンプルやナノメートル凹凸を有するサンプルへの適用が困難でした。また、共焦点顕微鏡は点計測に基づいているため、画像取得には焦点位置の機械的走査(スキャン)が必要となり、高速な画像取得が制限されていました。
上記の課題を解決するため、本研究グループは、光コム注2を光源に用いた光学顕微鏡を開発しました。光コムは、「光周波数の物差し」として光周波数計測や分光計測の分野で革命的進展をもたらしましたが(2005年ノーベル物理学賞)、本研究では、光コムの異なる特徴である「超離散マルチ光チャンネル性」に着目し、波長・空間変換注3とデュアルコム分光法注4を適用することにより、光位相と光振幅の共焦点顕微画像を機械的走査無く(スキャンレスで)高速に一括取得できる手法を開発・実証しました。本手法は、透明・非蛍光性の3次元培養細胞やマイクロ光学部品の品質評価、あるいは微小半導体部品のナノメートル欠陥検出への応用が期待されます。
本研究は、JST戦略的創造研究推進事業(グラント番号:JPMJER1304 詳細は以下参照)の他、文部科学省 科学研究費補助金 基盤研究(A)(課題番号:15H02026)により一部支援を受けて行われました。
本研究成果は、2018年5月16日午前10時(米国東部時間)にアメリカ光学会(The Optical Society)の電子ジャーナル「Optica」で公開されます。
<研究の背景と経緯>
共焦点顕微鏡は、1マイクロメートル(1000分の1ミリメートル)前後の空間分解能で3次元イメージングが可能であることから、バイオイメージングや非接触表面形状測定の分野で広く用いられています。従来の共焦点顕微鏡では、光強度に基づいて画像化するため、測定対象は反射性、散乱性、吸収性、または蛍光性である必要がありました。しかし、バイオ分野における代表的測定対象である細胞は一般に透明・非蛍光性であることから、そのままでは可視化できず、蛍光ラベリングを行わなければなりません。また、微細化が進む半導体部品の品質評価では、ナノメートル(100万分の1ミリメートル)オーダーの表面欠陥検出が必要とされていますが、共焦点顕微鏡の深さ分解能が1マイクロメートル前後であるため、そのような表面欠陥検出に利用することができませんでした。もし光強度の代わりに光位相で画像化できれば、屈折率、光学厚さ、幾何形状の情報を高精度に取得できるので、透明・非蛍光性サンプルやナノメートル凹凸サンプルの計測が可能になります。これまでにも、点計測に基づいて光位相の共焦点顕微画像は取得できましたが、焦点位置のスキャンに時間を要するため、画像を高速取得することは困難でした。
<研究の内容>
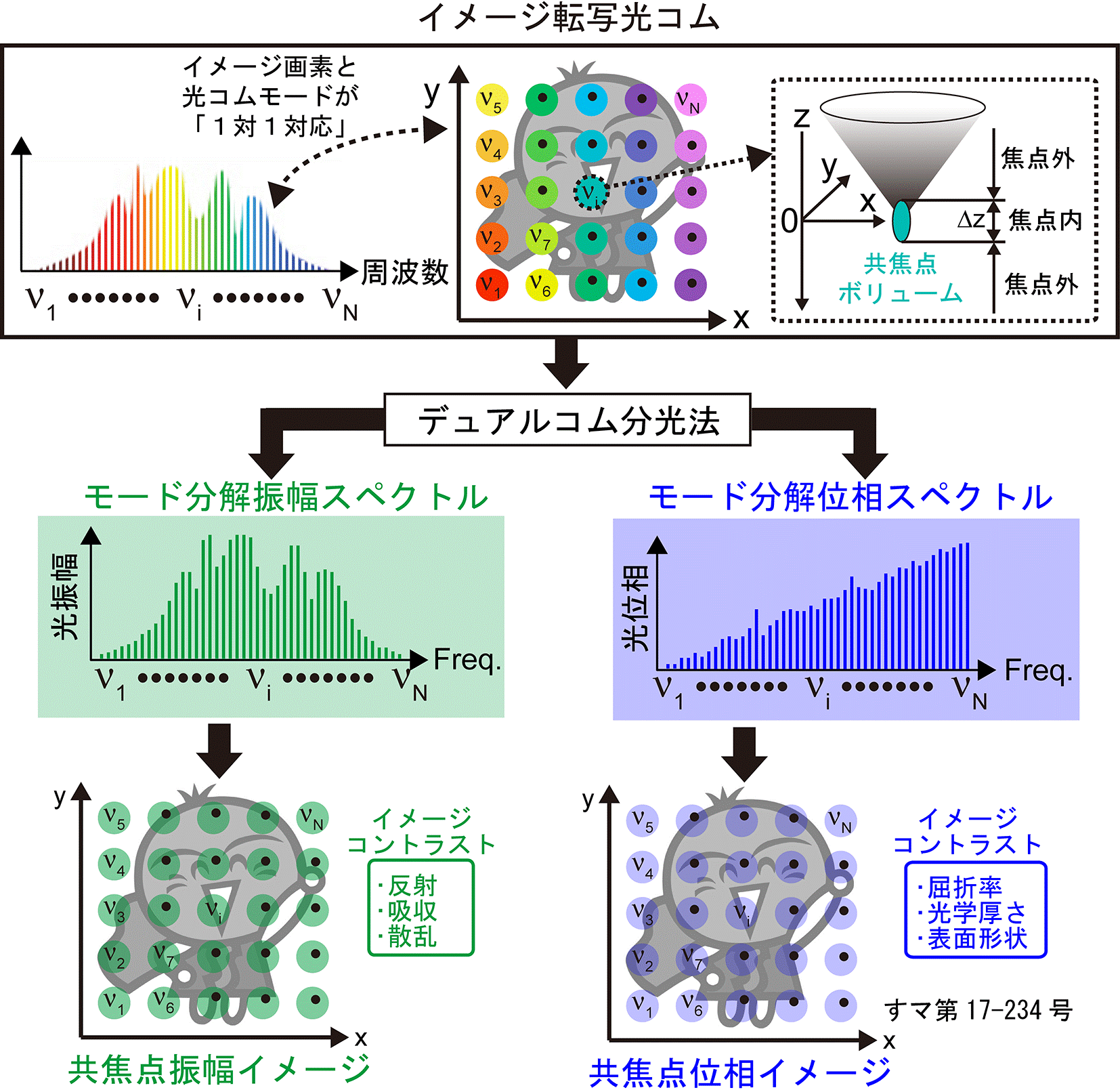
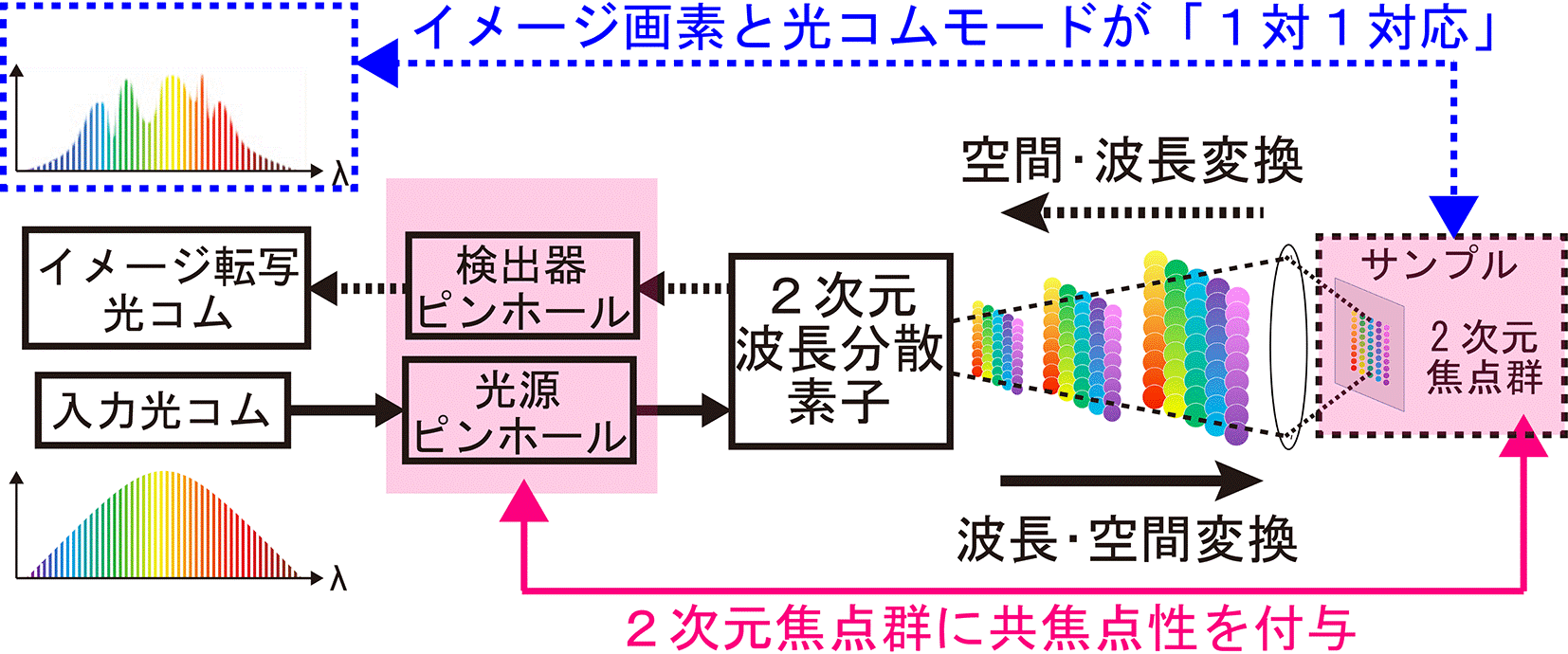
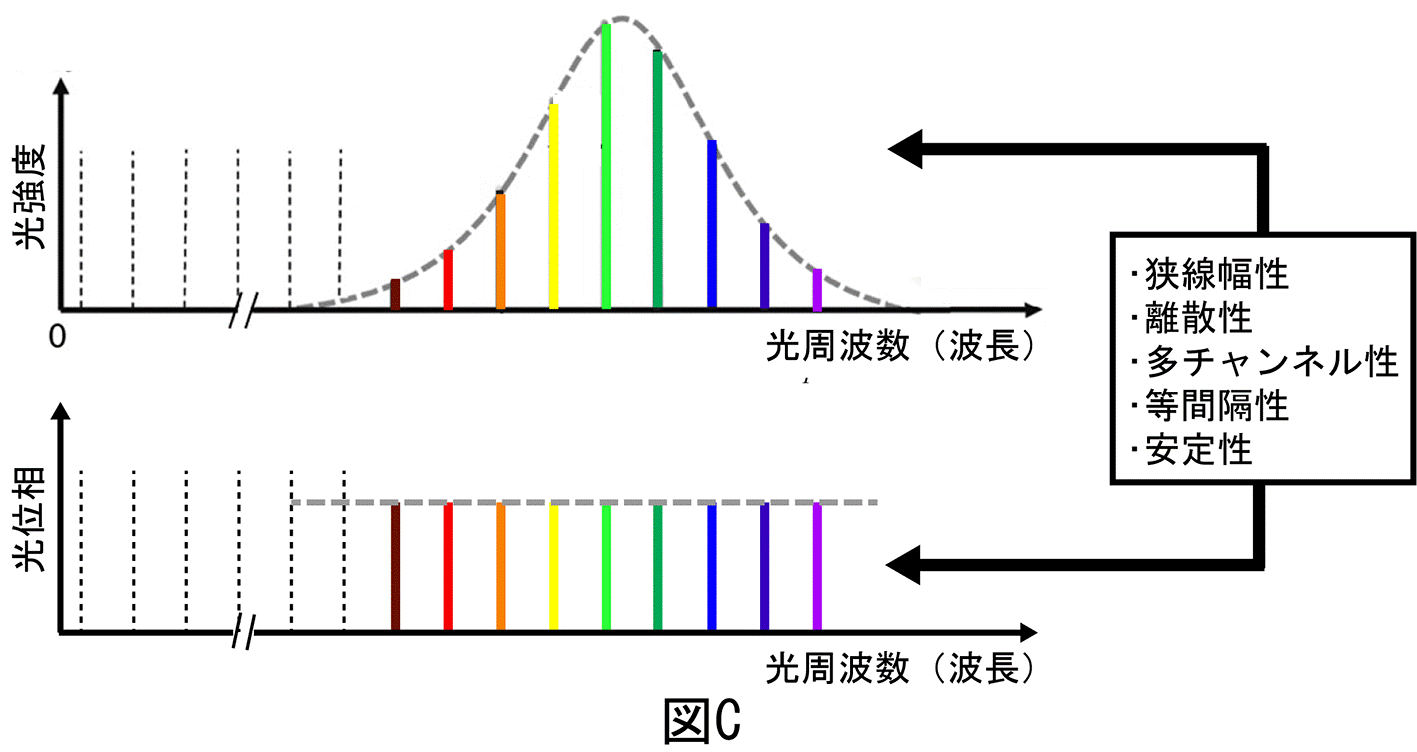
本研究では、共焦点顕微鏡の新しい光源として光コムに着目しました。光コムは、数万本から数十万本にも及ぶ狭線幅レーザー光が等間隔で整然と立ち並んだ櫛(comb:コム)の歯状スペクトル構造を持っており、光コムを構成する光周波数モード群(光コムモード群)の波長や位相は極めて高精度に制御されています。ここで、光コムを「超離散マルチ光チャンネル」と見立て、波長・空間変換により光コムモードを2次元空間に展開して、対物レンズで2次元焦点群としてサンプルに照射すると、サンプルのイメージ情報を光コムモードのスペクトルに転写させることが可能となります(図1下段)。サンプルから反射された2次元焦点群(光コムモード群)は、空間・波長変換によって再び空間的に重ね合わされた後、検出器側ピンホールを通過します(図1上段)。その結果、サンプルのイメージ画素と光コムモードを1対1対応させると共に、2次元焦点群に共焦点効果を並列で与えることが可能になります(図2上段)。このイメージ転写光コムをデュアルコム分光法で計測することにより、個々の光コムモードがスペクトル分解された振幅スペクトルと位相スペクトルを高速に取得します。最後に、イメージ画素と光コムモードの1対1対応関係に基づいて画像を再構成することにより、共焦点位相イメージと共焦点振幅イメージを一括して高速取得(最大で毎秒1,234イメージ)することができます。
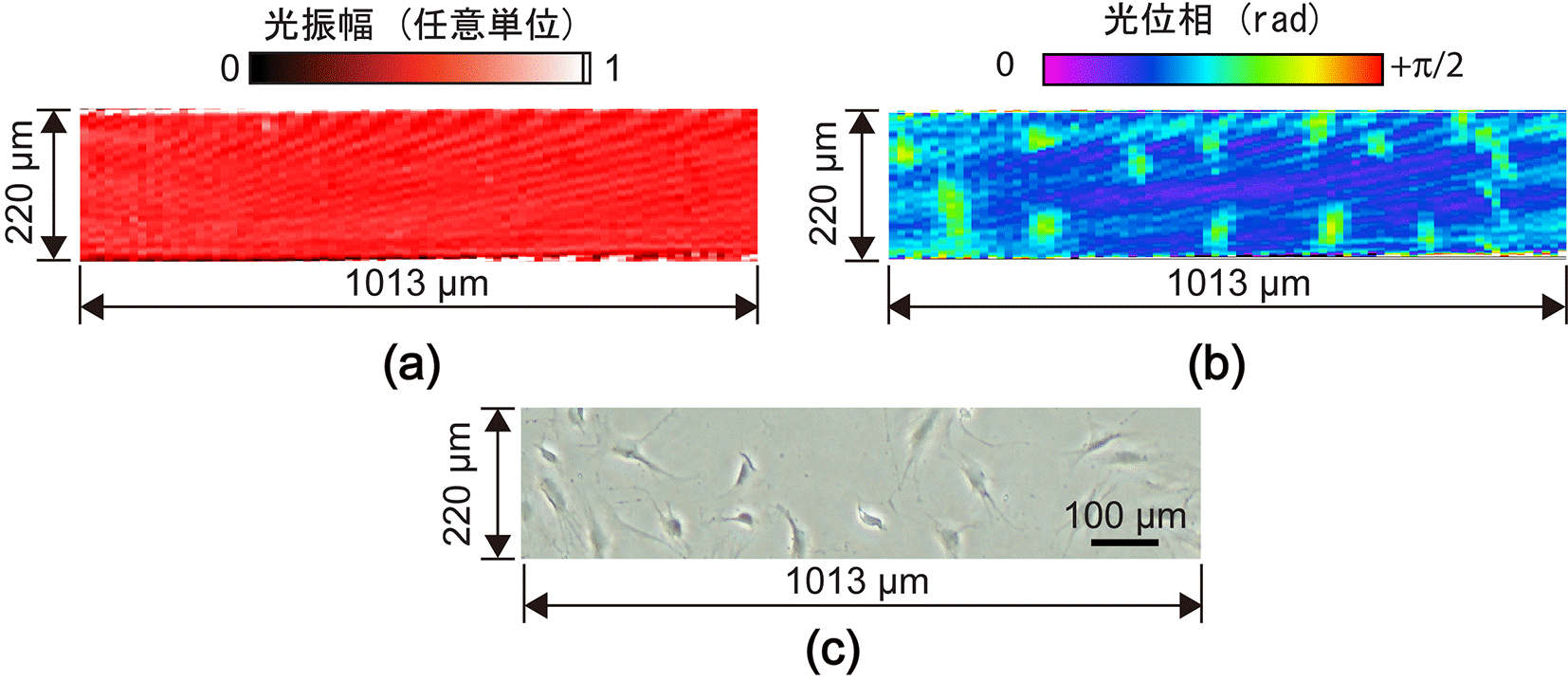
開発した装置の有用性を確認するため、まず透明・非蛍光性サンプルとして12時間静置培養された後にホルマリン固定された骨芽細胞を用いて計測しました。図3(a)の共焦点振幅イメージは従来の共焦点顕微鏡でも取得できますが、サンプルの透明・非蛍光性により、画像コントラストが得られていません。一方、提案手法によって取得できた図3(b)の共焦点位相イメージでは、サンプルとサンプル周囲の屈折率差に依存した光位相コントラストにより、楕円形状の骨芽細胞が分布している様子を可視化できています。比較のため、従来の位相差顕微鏡で同じサンプルを計測したところ、図3(c)に示すように骨芽細胞の分布が同様な形状と密度で確認できることから、正確に骨芽細胞を可視化できていると言えます。面内の空間分解能はまだまだ改良の余地はありますが、従来の位相差顕微鏡に対する優位性は、共焦点性により特定深さにおける光位相情報を選択的に定量値として得ることが出来ますので、立体的に培養された細胞サンプルの3次元分布を定量的に品質評価可能な点にあります。
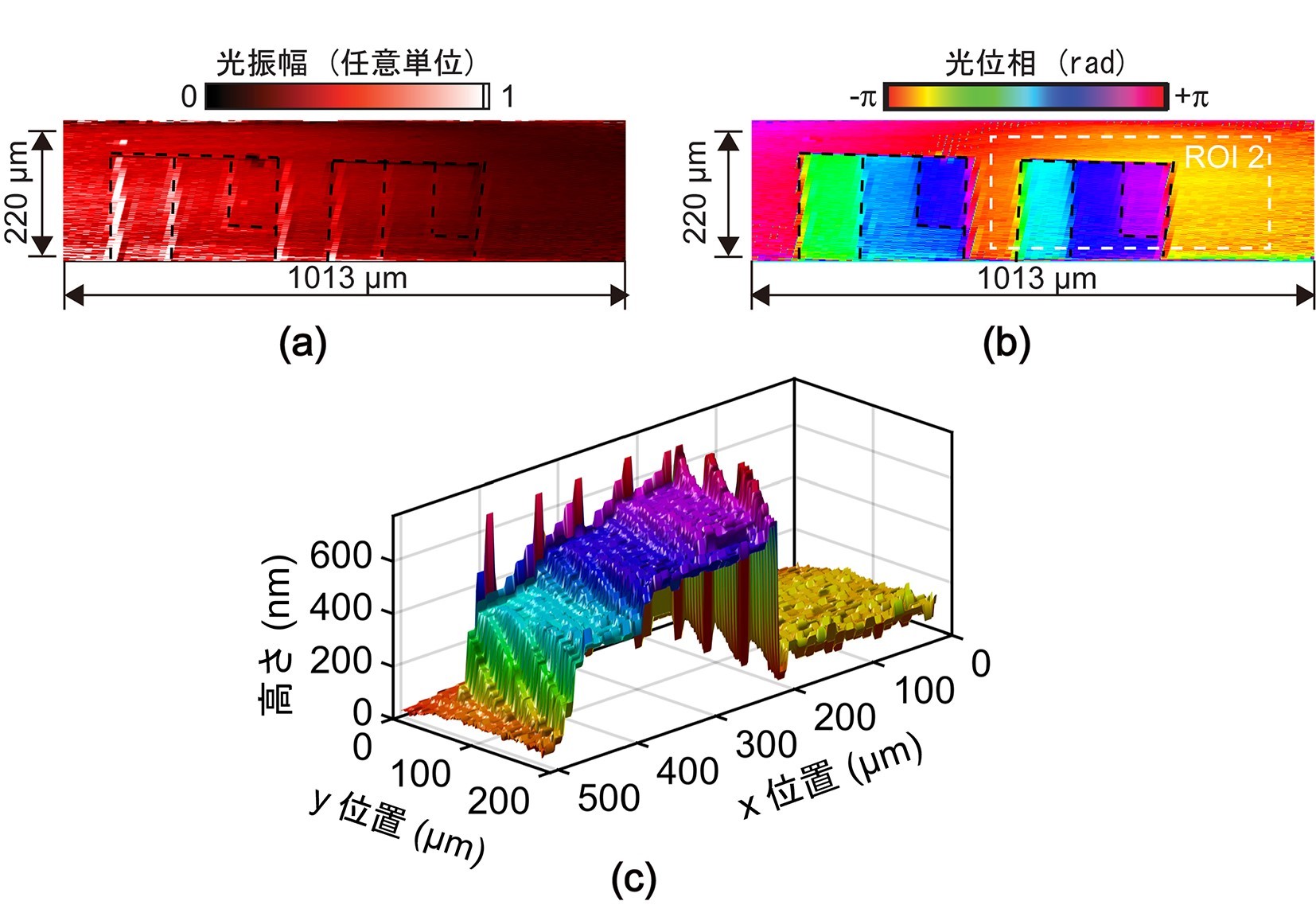
次に、ナノメートル表面形状測定への応用可能性を評価するため、金コートされたナノメートル凹凸のサンプルを作成し、計測しました。取得した共焦点振幅イメージおよび共焦点位相イメージが図4(a)および図4 (b)です。従来の共焦点顕微鏡でも取得できる共焦点振幅イメージでは、各段面の反射率がほぼ同じで、共焦点深さ分解能も段差を識別するには不十分なため画像コントラストがエッジ部分のみでしか得られていません。一方、共焦点位相イメージでは、ナノメートル段差は位相変化量として、明確に可視化されています。さらに、この共焦点位相イメージから3次元形状を可視化したものが図4 (c)です。それぞれの段差は、317ナノメートル、122ナノメートル、51ナノメートルとなり、これらの値は原子間力顕微鏡で測定した値と1パーセント以下の誤差で一致していました。
<今後の展開>
本技術は、バイオ分野や工業計測での利用が期待されます。例えば、組織工学や再生医用の分野では、高品位な細胞を3次元培養する必要がありますが、従来の位相差顕微鏡では立体培養細胞サンプルの3次元イメージングが困難であり、従来の共焦点顕微鏡を用いても、細胞を可視化するために用いる蛍光プローブが細胞に有害(侵襲的)であるため、細胞品質をありのままの生きた状態で時系列に評価することができませんでした。一方、本技術を用いると、培養細胞の非染色/非侵襲な3次元イメージングが可能になることから、細胞を常時計測することが可能になり、更にその計測結果に基づいて化学的あるいは力学的刺激をフィードバック制御することにより、3次元培養細胞の高品位化や高効率化が可能になると期待されます。また、1マイクロメーター前後の共焦点深さ分解能と、ナノメートルオーダーの位相深さ分解能を上手く接続することにより、ナノメートル〜マイクロメートル〜ミリメートルに及ぶワイドレンジな表面欠陥評価が可能になりますので、微細化が進む半導体、ナノ材料、金属、高分子の特性評価に有用であると考えられます。
| <参考図> | |
|---|---|
|
図1
|
波長・空間変換。2次元波長分散素子とレンズを用いた波長・空間変換により、光コムの個々のモードが2次元焦点群としてサンプルに照射されます(下段)。サンプルのイメージ情報が転写された光コム2次元焦点群は、同じ光学系を用いた空間・波長変換により再び空間的に重ね合わされます(上段)。その結果、イメージ画素と光コムモードを1対1対応させることが可能になります。さらに、波長・空間変換前および空間・波長変換後にピンホールを配置することにより、2次元焦点群に共焦点性を与えることができます。 |
|
図2
|
イメージが転写された光コムは、イメージ画素と光コムモードが1対1対応し、2次元焦点群の全てに共焦点性が与えられています。このイメージ転写光コムをデュアルコム分光法で計測すると、個々のイメージ画素に対応した光振幅と光位相の値が、モード分解振幅スペクトルおよびモード分解位相スペクトルとして得られます。取得したこれらのスペクトルに対して、イメージ画素と光コムモードの1対1対応関係を適用することにより、共焦点振幅イメージおよび共焦点イメージを一括取得することができます。 |
|
図3
|
培養骨芽細胞の計測。(a)共焦点振幅イメージ、(b)共焦点位相イメージ、(c) 位相差イメージ。(a)は光強度に基づいてイメージにコントラストを与えているので、透明・非蛍光性の細胞を可視化することが出来ていません。(b)は光位相に基づいてイメージにコントラストを与えているので、サンプルとサンプル周囲の屈折率差を反映した細胞分布が可視化できています。(c)も光位相に基づいてイメージにコントラストを与えており、細胞分布が可視化できていますが、そのイメージ輝度は深さ方向の情報が積分されたものであり、また定量的な数値として評価することが困難です。 |
|
図4
|
ナノメートル凹凸サンプルの計測。(a)共焦点振幅イメージ、(b)共焦点位相イメージ、(c) 3次元形状。(a)は光強度に基づいて画像化していますが、各段面の反射率はほぼ同じで、共焦点深さ分解能もナノメートル凹凸を識別するには不十分なので、散乱反射により信号が減衰するエッジ部分のみでしかイメージコントラストが得られていません。また、(b)は光位相に基づいて画像化しているので、サンプルのナノメートル凹凸による光位相の遅れが定量的数値としてと可視化できています。(c)は、(b)の位相分布から波長と光速を考慮して算出された3次元形状となっており、サンプルにおけるナノメートル凹凸の様子が確認できます。 |
| <用語解説> |
|---|
|
注1)共焦点顕微鏡 |
|
注2)光コム |
|
注3)波長・空間変換 |
|
注4)デュアルコム分光法 |
| [論文タイトル] |
|---|
|
Scan-less confocal phase imaging based on dual-comb microscopy |
| [お問い合わせ先] | |
|---|---|
|
<研究に関すること> |
|
|
<JSTの事業に関すること> |
|
|
<広報に関すること> 機 関 電気通信大学 総務課広報室広報係 機 関 科学技術振興機構 広報課 |
| 【関連リンク】 |
|---|
|
▽アメリカ光学会(The Optical Society)電子ジャーナル「Optica」 |
|
▽戦略的創造研究推進事業(ERATO)美濃島知的シンセサイザプロジェク |